Zymo Research的新冠病毒收集/运输设备获得510(k)许可
加州尔湾2021年3月12日 /美通社/ -- Zymo Research今天宣布,美国食品和药物管理局(FDA)已批准其DNA/RNA Shield™采集管作为二类医疗器械。FDA的510(k)许可允许该产品用作新冠肺炎病毒检测的体外诊断(IVD)设备。
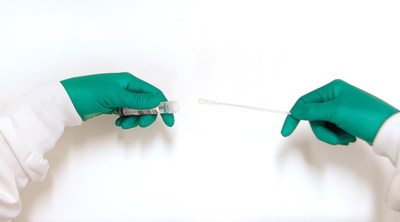
DNA/RNA Shield™采集设备专门用于新冠病毒检测,是经FDA批准的第一项病毒灭活并保留SARS-CoV-2 RNA的技术。 SARS-CoV-2病毒可经过有效灭活,因此可以安全地处理、运输和储存样本。这可为一线医疗和实验室工作人员提供安全保障。在环境温度下,病毒RNA可保持长期稳定性,以通过下游RT-PCR进行可靠分析。
“在此次疫情之前, DNA/RNA Shield在多种传染病应用方面有过良好的记录,这促进了该技术在新冠疫情早期阶段获得快速采用和部署,” Zymo Research业务开发副总裁Marc Van Eden表示, “510(k)许可是FDA与Zymo Research积极合作将这项技术推向当前测试和未来监控工作最前沿的结果。”
该产品包含一个填充有Zymo Research独有DNA/RNA Shield™运输介质的试管。在环境温度条件下,运输介质可确保SARS-CoV-2 RNA在采样运输和储存过程中保持稳定性达28天。DNA/RNA Shield™运输介质可能包含一个拭子、痰收集套件,也可能作为一个单独的试管提供。
该技术适用于疑似含有SARS-CoV-2的上、下呼吸道人类标本。收集和储存在DNA/RNA Shield™采集管中的标本适合用于适当的分子诊断测试。
- HER2双抗KN026 Ⅲ期临床试验申请获CDE正式受理2021-03-12 08:31:25
- 比尔及梅琳达·盖茨基金会承诺帮助低收入国家加速获取新冠肺炎药2021-03-12 08:31:25
- 金邦达荣获“2021中国企业ESG最佳公司治理(G)案例奖”2021-03-12 08:31:25
- 诺诚健华荣获“2021最佳原研小分子化学药TOP3企业”鲲鹏...2021-03-12 08:31:25
- 诺诚健华荣获“2021最佳原研小分子化学药TOP3企业”鲲鹏...2021-03-12 08:31:25